<<retornar ao índice - ENEM 2017
Resolução comentada - ENEM 2017 - Questão 95
escute agora ou download PODCAST (5min, 4,5 MB)
Perceba que uma corrente elétrica pode fluir pelo líquido
A eletrólise do cloreto de sódio (NaCl) visa extrair o elemento cloro, na sua forma natural nas CNTP que é um gás. Como subprodutos temos o hidrogênio e a soda cáustica, produzidos na eletrólise do NaCl em solução aquosa.
A eletrólise pode ocorrer usando-se o NaCl derretido (1)ou em solução aquosa (2).
1 - No caso do sal derretido (este sal derrete a 800°C) o processo é mais fácil de ser entendido.
(imagem NaCl)
Quando se aplica a corrente elétrica no sal derretido, os íons Cl- migram para o eletrodo positivo (anodo) e os íons Na+ migram para o eletrodo negativo (catodo).
Desta forma se produz cloro no estado gasoso (Cl2 ) e sódio no estado metálico (Na).
Note que no NaCl sólido as cargas (íons Na+ e Cl- ) estão imobilizadas e portanto não se movimentam e nada acontece.
Porque o eletrodo positivo às vezes é o anodo e outras vezes é o cátodo? Resposta aqui
2 - No caso da solução aquosa a situação é um pouco mais complicada, devido à presença da água e portanto de outros íons que se envolvem no processo.
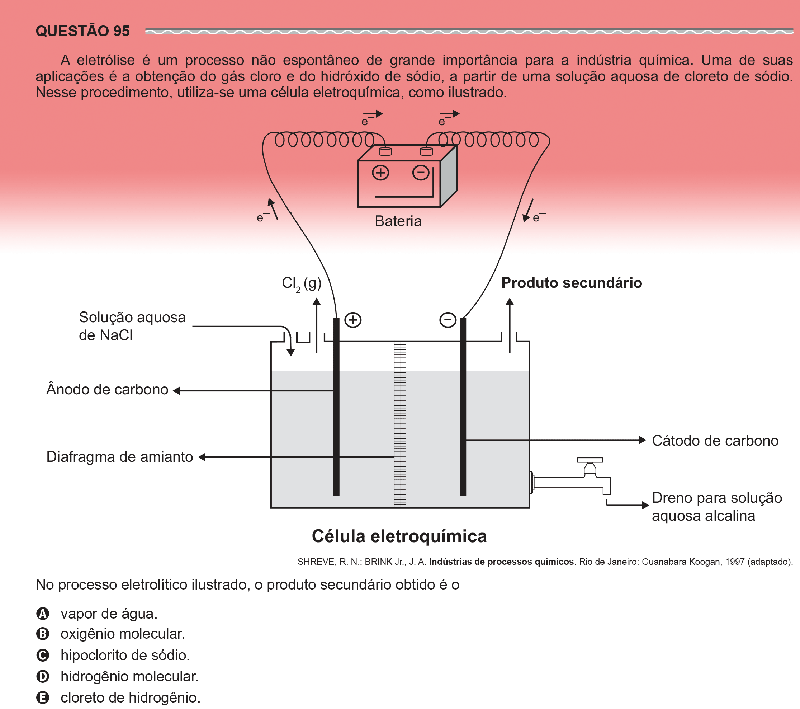
Com relação ao eletrodo positivo, onde se forma o gás cloro, nada muda (Lembremos que o cloro é o principal produto obtido deste processo). Os íons Cl- migram para o eletrodo positivo, que neste caso é o anodo, onde perdem eletrons (oxidação) e se juntam em pares para formar o Cl2:
Para o eletrodo negativo se dirigem os íons positivos. Alem do Na+, existem também íons H+ (ou H3O+) formados devido à auto-ionização da água:

Qual destes dois, H+ e Na+, será reduzido (receberá elétron) no cátodo? Resposta: Será aquele que tem maior afinidade por elétrons. Aquele com mais fome de elétrons, digamos em um sentido figurado (personificação). Este será o hidrogênio e portanto haverá a formação de gás hidrogênio (H2). O Na+ permanecerá em solução e juntamnete com as hidroxilas (OH-) formará NAOH (soda cáustica), que é um subproduto do processo.
Resposta d).
A série eletroquímica
Como sabemos que H+ tem mais "fome" de elétrons do que o Na+ ?
Basta consultar a série eletroquímica, onde os potenciais de redução são atribuidos às diversas reações de oxi-redução. Abaixo mostro alguns valores de potenciais de reduçaõ:
O hidrogênio recebe o potencial zero, por convenção. Os elementos com potencial de redução negativo (portanto menor que o do hidrogênio) tem menos "fome" de elétrons do que o hidrogênio. Os elementos com potencial de redução positivo tem mais fome. Quanto maior o valor, maior a fome!
No caso do sódio temos:
| Na+ e− --> | Na(s) | −2.71 |
Isso explica porque forma-se no cátodo o hidrogênio e não sódio.
Este processo é usada em larga escala, em fábricas inteiras construídas apenas para produzir cloro.
O jornal inglês The Guardian relata que uma fábrica dessas pode ter indicado a entrada da Inglaterra na guerra do Iraque (https://www.theguardian.com/politics/2003/mar/06/uk.iraq). Sadam Hussein fabricava cloro, por eletrólise, supostamente para usá-lo em armamento químico (chemical weapons). O gás cloro foi o primeiro a ser usado como arma química em uma guerra. Em seguida forma descobertos outros gases mais letais, fabricados com base no cloro. Por exemplo o gás mostarda, o tabun e o sarin (usado no atentado terrorista ao metrô de Tóquio). Ou seja , que o processo de eletrólise do sal de cozinha é o início desta cascata de reações química que podem produzir armas químicas altamente letais.
Claro que o cloro também possui muitos usos pacíficos, como por exemplo em desinfecções diversas (matando germes) ,no branqueamento de papel e outros materiais, piscinas etc... Na maioria das vezes não se usa o gás cloro mas sim derivados deste, como o hipoclorito de sódio.
A indústria de pesticidas nasceu com base em compostos orgânicos a base de cloro (organoclorados), como o famoso DDT ( e seus derivados).
É também muito utilizado em plásticos (cloreto de polivinila).
Resolução comentada em vídeo:
<<retornar ao índice - ENEM 2017

 HOME PAGE
HOME PAGE